Différence clé: La masse atomique est simplement la masse d'un isotope spécifique, ou la masse combinée des protons, des neutrons et des électrons de l'atome. Le numéro atomique est le nombre de protons que l'on trouve dans le noyau d'un élément.
Regardons les choses en face, la chimie est source de confusion: quantité d'éléments, nombres atomiques, liaisons, masse, poids, atomes, etc. Bien la masse atomique et le numéro atomique sont deux de ces mots qui sont souvent confondus et utilisés de manière interchangeable.
La masse atomique est la masse d'un atome lorsqu'il est au repos. En effet, lorsqu'un atome se déplace à très grande vitesse, sa masse a tendance à augmenter. Bien que, selon la définition, la masse atomique soit la masse de tous les protons, neutrons et électrons, les électrons sont trop petits pour faire toute différence significative dans la masse atomique. La plupart des éléments du tableau périodique ont des isotopes et, en raison de la différence dans le nombre de neutrons, la masse de chaque isotope change également.
La masse atomique est exprimée en unités de masse atomique ou amu. Une unité de masse atomique est égale à 1 / 12ème de la masse de carbone 12. Lorsque la masse d'un atome est divisée par 1 / 12ème de la masse de carbone 12, la masse relative de l'élément est obtenue. Cependant, la masse relative d'un objet est en réalité le poids atomique d'un élément, tel qu'il est calculé en considérant l'ensemble des isotopes. Bien que, cela ne devrait pas être supposé comme masse atomique d'un élément.

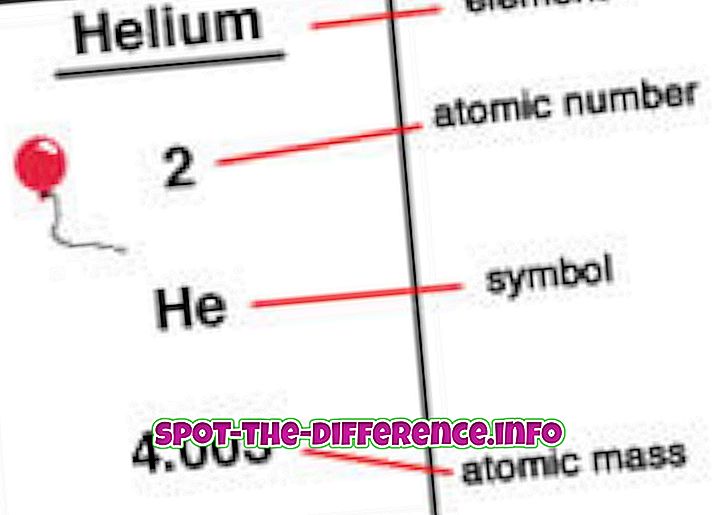
Le numéro atomique est le nombre de protons que l'on trouve dans le noyau d'un élément. Lorsqu'un atome est neutre, cela signifie qu'il a le même nombre de protons et d'électrons. Le numéro atomique est désigné par un Z. Étant donné que chaque élément a un nombre de protons différent, ce nombre est également utilisé pour représenter un élément. Les isotopes partagent généralement le même numéro atomique mais sont classés en fonction de leur masse atomique, par exemple le carbone 12, le carbone 13.
Les éléments sont placés dans l'ordre du numéro atomique sur un tableau périodique. Le numéro atomique est répertorié dans le coin supérieur gauche de l'élément en tant qu'exposant. Les numéros atomiques peuvent aider à divulguer des informations sur l'élément et beaucoup de personnes peuvent voir le numéro atomique et indiquer de quel élément il s'agit. Il indique également où, dans le tableau périodique, il peut être placé et s'il est liquide, gazeux ou solide. Le numéro atomique fournit également des informations sur la charge du noyau, les états d'oxydation, le comportement des liaisons, la charge de l'ion, etc.